
Les antioxydants et le stress oxydatif
On a beau avoir une santé de fer, on finit toujours par rouiller.
Jacques Prévert, poète, scénariste et artiste français. 1900 – 1977
Jacques Prévert connaissait- t’il les antioxydants ? Aucune idée, mais, il ne pouvait dire plus vrai. Notre corps, tout comme les métaux, fait face à de constantes attaques oxydatives. L’oxygène est essentiel à notre survie, mais, son utilisation par les cellules du corps n’est pas sans danger. Une partie significative (1-2 %) de l’oxygène que nous respirons est transformée en dérivés toxiques appelés radicaux libres. Cependant, ces molécules très réactives ne sont pas que des ennemies car elles ont des fonctions biologiques importantes en intervenant notamment dans la signalisation cellulaire. Nous en avons donc besoin mais, lorsqu’elles sont en excès, elles peuvent aussi s’attaquer à tous les constituants du vivant et favoriser les maladies chroniques. Les antioxydants ont donc un rôle important soit d’empêcher les radicaux libres d’endommager les composantes cellulaires comme les protéines, les lipides et l’ADN.
Au cours du vieillissement, la génération de radicaux libres augmente et leur quantité devient supérieure à la capacité des défenses antioxydants de notre organisme dont le glutation. Ce déséquilibre appelé stress oxydatif va mener l’organisme vers un état pathologique. L’oxydation des biomolécules par les radicaux libres est impliquée dans plusieurs pathologies comme les maladies cardiovasculaires (artériosclérose), les maladies neuro dégénératives (Parkinson, Alzheimer), le cancer, les cataractes, ainsi que le vieillissement. Elle est aussi à la base de la formation des rides. Une consommation riche en composés antioxydants pourrait en atténuer l’impact.
Un radical libre c’est quoi?
Dans nos molécules, les électrons sont normalement groupés par paires et tournent autour du noyau. Un radical libre est une molécule possédant un seul électron et les radicaux libres qui ne comportent qu’un seul électron sont en principe instables. Une cellule malade, c’est-à-dire une cellule à laquelle il manque un électron, cherche à se stabiliser ou à se soigner. Elle attaque donc une autre cellule pour lui voler un électron. La molécule ainsi attaquée et qui y laisse un électron devient un radical libre. Ce radical libre cherche à son tour de récupérer l’électron manquant sur une autre cellule et cela devient une éternelle réaction en chaîne. En biologie, les radicaux libres produits dans ces réactions peuvent finir par modifier entièrement les propriétés d’une molécule. On parle alors de lésion cellulaire.

Le stress oxydatif et ses effets sur la santé
Les dangers des radicaux libres.
Oxydant/ antioxydant
Par définition, un antioxydant est une substance à faible concentration comparée à celle du substrat oxydable capable de retarder ou d’arrêter l’oxydation du substrat. En termes imagés, la coque d’acier d’un bateau et l’eau saline qui la fera rouiller à coup sûr. L’antioxydant? La peinture qui recouvre la coque et qui empêche l’eau salée d’attaquer le métal. Plus la peinture est protectrice et épaisse, plus la protection de la coque d’acier contre la rouille est forte et efficace.
Le glutathion, le plus puissant des antioxydants
On ne cesse de parler des antioxydant qu’on retrouve dans notre alimentation sans jamais parler de la glutathion qui est un antioxydant nettement plus puissant que n’importe lequel antioxydant apporté par l’alimentation. Il prend naissance dans notre corps et est l’antioxydant naturel le plus important de ce dernier. Sa production est réalisée par le foie. Le glutathion, un composée de 3 acides aminés, la cystéine, l’acide glutamique et la glycine, contrôle la plupart des processus vitaux de nos cellules. C’est une molécule que l’on considère comme essentielle à l’apparition de la vie humaine.
Le glutathion aide à prévenir les dommages des composants cellulaires provoqués par les dérivés actifs de l’oxygène tels les radicaux libres. Tout en optimisant le fonctionnement du système de défenses naturelles, le glutathion favorise l’élimination de polluants en se liant aux toxines pour les transformer en composés hydrosolubles facilement éliminés dans la bile ou les urines. Il participe à l’élimination des métaux.
Pour ce qui est des métaux dits lourds, ce sont seulement quelques-uns d’entre eux qui n’ont pas d’utilité pour l’organisme de l’homme. Le plomb, le cadmium et le mercure en font parti. Si la communauté internationale utilise toujours le terme métaux lourds comme synonyme de métaux toxiques, c’est qu’ils sont de plus en plus présents dans notre environnement. Ils sont dans l’air, dans l’eau que nous buvons et même dans les légumes que nous mangeons. Le mercure est un des plus toxiques car dans chaque cellule on estime qu’il y a 100,000 réactions chimiques qui dépendent tous d’enzymes. Toutes les recherches sur le mercure n’ont pas trouvé une seule enzyme que le mercure n’affecte pas. Le glutathion est très important pour le mécanisme de détoxification de l’organisme car il peut entre autres se lier au mercure, le capturer et l’en faire sortir.
Une équipe de recherche d’Atlanta réalisée par Dr. Dean Jones en 2002 nous a appris qu’à l’approche de la cinquantaine, l’homme et la femme deviennent beaucoup plus fragiles face aux radicaux libres et que cette fragilité serait due à un déclin du glutathion. D’ailleurs, 45-50 ans correspondent à l’âge critique du vieillissement humain. C’est durant cette période de notre vie que nous commençons à connaitre les phénomènes de dégénérescence. En plus de l’âge qui réduit naturellement le glutathion, il y a beaucoup de facteurs de la vie moderne qui viennent amplifier le problème. On y compte entre autres les polluants, les pesticides, le stress émotionnel, les médicaments, les exercices trop intenses, le tabac, l’alcool, les rayons ultra-violets, les additifs alimentaires et les agents de conservation.
Nous devons donc compenser car, de faibles niveaux de glutathion sont associés à un ensemble de troubles et problèmes dont les pertes de mémoire, les tremblements et la mauvaise coordination. Nous pouvons en partie du moins y remédier par une alimentation variée riche en fruits et légumes, mais aussi en protéines animales et en céréales les moins transformées possibles.
Malgré son rôle essentiel, le glutathion est rarement prescrit par les médecins et peu commercialisé dans les pharmacies où l’on préfère vous proposer de la vitamine C ou de la vitamine E de synthèse comme antioxydants.
L’indice ORAC c’est quoi et est-ce réellement révélateur de la capacité antioxydant d’un aliment ?
L’ORAC est l’acronyme pour Oxygen Radical Absorbance Capacity. En français, sa signification est la suivante : capacité d’absorption des radicaux oxygénés. C’est une méthode de mesure des capacités antioxydants dans des échantillons biologiques. En court, un (1) ORAC représente la capacité antioxydant de la vitamine E. Un aliment qui a 10 ORACS a donc 10 fois la capacité d’arrêter l’oxydation que le Vitamine E. Ça, c’est théorique mais qu’en es- t’il en pratique ?
Un test ORAC se fait en laboratoire et non sur l’humain. C’est un instrument de mesure très utile pour la communauté scientifique qui le considère comme un excellent indicateur, mais, un indicateur qui doit être mis en contexte et non pris à lui seul. En effet, un aliment peut avoir un ORAC très puissant et ne pas être efficace du tout. Par exemple, plusieurs molécules composant un aliment ou même un médicament ne réussissent pas aux acides digestifs et sont éliminés avant d’être utilisées par notre organisme et sont, par le fait même, inefficaces. Cela explique en partie que certains médicaments doivent être donnés par intraveineuse. Avoir en soi un fort ORAC ne veut donc pas dire à lui seul qu’il soit efficace sur l’organisme. Un peu comme un gros moteur ne peut transmettre sa puissance sans transmission.
Sur la liste officielle de l’USDA apparaissait tout au sommet l’ORAC le clou de girofle. Et c’était un ORAC de 25,000. Pour le bleuet sauvage que le USDA considérait et considère toujours comme un, sinon l’antioxydant le plus complet et puissant au monde, son ORAC variait entre 30 et 45 dépendamment des espèces et de leur lieu d’origine. En fait, l’antioxydant le plus recherché que contient le bleuet est l’anthocyane, cette molécule active contre le cancer, les maladies neuro-dégénératives telles l’Alzheimer, le Parkinson, la vision, la qualité de la peau, enfin, tout ce qu’on reconnait au bleuet comme apport santé. Pour le clou de girofle, la molécule active recherchée est l’eugénol. Ce dernier est très puissamt pour éliminer les bactéries. Il a aussi de fortes propriétés et est utilisé pour soulager les maux de dents. L’eugénol du girofle est à l’origine de son parfum fort et tonique. L’apport santé du clou de girofle est-il plus de 600 fois celui du bleuet ? Pas du tout. Cela démontre l’importance de ne pas prendre l’ORAC comme une valeur absolue qui dicte ce que nous devons consommer pour demeurer en santé.
L’interprétation et surtout l’utilisation qu’en on fait certains joueurs de l’industrie des produits de santé naturels et des aliments furent tellement biaisées que le USDA a dû retirer la liste des valeurs ORAC qu’elle rendait publique sur son site internet.
Trop, c’est comme pas assez!
Selon le Dr. Richard Béliveau, un des chercheurs québécois les plus réputé, il faut être prudent avec la prise d’antioxydant car trop serait comme pas assez. Selon lui, même si en théorie l’administration de doses massives d’antioxydants capables de neutraliser l’action destructrice des radicaux libres devrait avoir des effets très positifs sur la santé, ce ne serait malheureusement pas le cas. En effet, un très grand nombre d’études réalisées durant les 20 dernières années ont clairement démontré que la prise massive de certains antioxydants ne réduit aucunement le risque de maladies du cœur ou de cancer et que, tout au contraire, leur prise excessive est associée à une hausse du risque de mortalité. En ce sens, de fortes quantités de vitamine E semblent particulièrement nocives, puisque ces suppléments provoquent une augmentation marquée du risque de cancer du poumon lorsque combinés avec le bêta-carotène (chez les fumeurs), une hausse importante du risque de cancer de la prostate, et une diminution significative de l’espérance de vie.
Toujours selon Dr. Béliveau, Il est donc probable que les concentrations anormalement élevées d’antioxydants pris sous forme de suppléments interfèrent avec certaines fonctions importantes jouées par les radicaux libres et perturbent du même coup le fonctionnement normal de l’organisme
(Référence : Dr. Richard Béliveau, Journal de Montréal, 22 mai 2016).
Classification des grandes classes d’antioxydants d’origine alimentaire
Les antioxydants d’origine alimentaire se classent en 4 catégories:
– les caroténoïdes
– les vitamines,
– les oligo-éléments
– les polyphénols.
Les polyphénols
Les polyphénols sont des composés chimiques naturellement présents dans le règne végétal, en particulier chez les baies nordiques. Il existe plus de 8000 molécules phénoliques différentes, comme les molécules simples, telles les acides phénoliques, les molécules beaucoup plus compliquées (tannins) et d’autres qui peuvent être complexées à des sucres, à des protéines et même à des lipides.
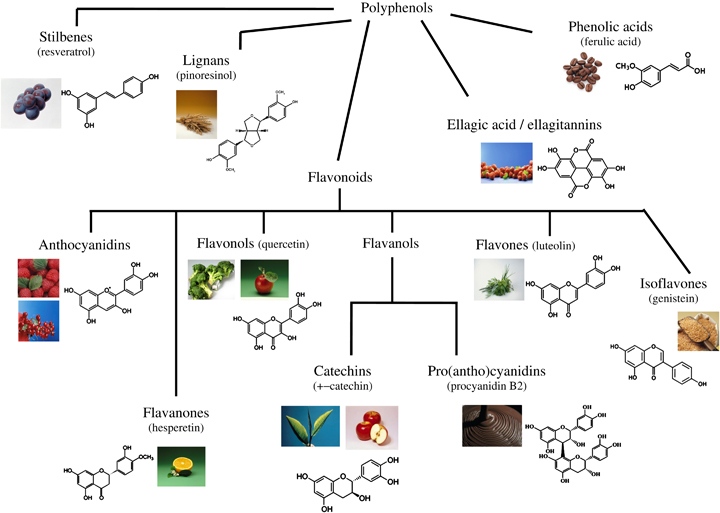
Les flavonoïdes pour leur part sont présents dans tout le règne végétal, à l’exception des champignons et des algues. Ce sont des dérivés des polyphénols hydrosolubles (solubles dans l’eau), souvent incolores ou jaunes (sauf exceptions, comme les anthocyanes). Les flavonoïdes constituent en eux-mêmes une famille de composés extrêmement vaste, jouant des rôles physiologiques importants (nutritionnel, médicinaux, filtres UV…). Ils sont présents dans les petits fruits du Québec, présentent un intérêt particulier pour la santé humaine et font l’objet de nombreuses allégations médicinales, particulièrement pour leur forte capacité antioxydant.
Les flavonoïdes sont eux-mêmes classés en fonction de leur degré d’oxydation en sous-groupes tels que:
– les flavonols
– les flavones
– les flavanols
– les isolflavones
– les pro anthocyanidines
– les anthocyanes (Réf 4 W)
Les isoflavones
Les isoflavones sont des composés que l’on retrouve surtout chez les légumineuses (par exemple dans le soja dont les propriétés phytoestrogènes sont largement étudiées). Certains dérivés de l’isoflavone sont des agents puissants contre certaines bactéries. Ils ont des propriétés bactériostatiques et sont spécifiquement induits lors d’infections par des organismes phytopathogènes. On retrouve en particulier de nombreuses phytoalexines dans les légumineuses (ex: phaséolline du haricot, glycéolline du soja)
Les pro anthocyanidines dont les dérivés hétérosides sont appelés pro anthocyanes sont des composés flavonoïdes présents dans de nombreux végétaux, en particulier dans la peau et les pépins de raisin et de canneberge.
Les anthocyanes du bleuet
Les anthocyanes sont des flavonoïdes que l’on retrouve dans le règne végétal et qui donnent la couleur caractéristique des feuilles, des fleurs et des fruits. Ce sont des composés colorés (orange, pourpre à bleu) et généralement hydrosolubles. Contrairement aux autres flavonoïdes, les anthocyanes absorbent la plus part du temps dans le spectre de l’ultra violet. Elles participent largement dans la coloration des pétales, mais on les retrouve également dans de nombreux tissus végétaux. Leur synthèse dans les organes foliaires est souvent activée par le stress (froid, carences, sénescence…). Leurs composés sont très souvent utilisés comme colorants alimentaires et présentent des propriétés antioxydant.
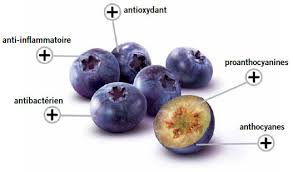
Les anthocyanes ont été étudiés d’après plusieurs activités biologiques incluant la capacité antioxydant, l’effet sur la perméabilité et la fragilité des vaisseaux capillaires, l’agrégation des plaquettes de sang et l’effet sur le collagène (Réf 5 W). La capacité antioxydant des anthocyanes est l’une des propriétés biologiques les plus importantes. La recherche épidémiologique et biomédicale suggère que les antioxydants contenus dans les petits fruits, tels que le bleuet, l’airelle et la canneberge, peuvent jouer un rôle préventif sur l’apparition de certaines maladies comme le cancer, les maladies cardiovasculaires et les maladies neurodégénératives telles que l’Alzheimer et le Parkinson. Les anthocyanes et les autres flavonoïdes apportent une contribution substantielle aux antioxydants totaux du régime alimentaire (Réf 6 et 7 W). Les anthocyanes seraient un antioxydant naturel 20 fois plus efficace que les vitamines A et C.
Où trouve- t’on les antioxydants alimentaires?
Au cours d’un repas équilibré, on retrouve facilement ces quatre groupes d’antioxydants mais la majorité des suppléments alimentaires contiennent des antioxydants de synthèse. Par contre, il semble que les antioxydants de sources alimentaires ont une bio activité beaucoup plus élevée que ceux des suppléments provenant d’extraits synthétiques. Ceci est dû d’une part au fait que les aliments contiennent une plus grande hétérogénéité d’antioxydants et d’autre part, les antioxydants synthétiques sont moins bien absorbés par le corps humain.

La consommation de petits fruits et ses effets sur la santé
Rien de mieux que les petits fruits pour votre santé
On connaissait déjà les bienfaits d’une alimentation équilibrée en fruits et légumes pour le maintien d’une bonne hygiène de vie. Consommer les quantités recommandées dans le nouveau Guide alimentaire canadien réduit les risques d’apparition de plusieurs maladies. La forêt boréale québécoise, qui compte plus de 850 espèces de plantes vasculaires (10), représente une source abondante de composés utiles pour le traitement et la prévention de différentes maladies. Plusieurs plantes de ce vaste écosystème contiennent une haute concentration en composés antioxydants. Le bleuet nain sauvage, la plaquebière la canneberge et sa proche cousine l’airelle rouge vitis-idaea sont réputés pour leur forte teneur en composés antioxydants et, par conséquent, sont souvent considérés comme des références à ce niveau. De nombreuses études démontrent que les antioxydants retrouvés dans les baies boréales possèdent des propriétés protectrices remarquables (10–58).

Plusieurs études ont aussi démontré que, pour une personne en santé, la consommation de fruits riches en antioxydants réduisait les risques d’apparition de maladie cardiovasculaire de cancer d’obésité et de diabète (Réf 2, 3 W). Bien que les petits fruits soient qualifiés de petits seulement selon des critères de masse ou de volume, les études montrent qu’ils présentent généralement des concentrations beaucoup plus élevées que les autres fruits ayant des composés à haute valeur nutritionnelle, telle que les antioxidants, les vitamines C et E. Parmi ces petits fruits on note le bleuet sauvage, l’airelle rouge et la canneberge. Ces petits fruits présentent un intérêt particulier, d’un point de vue organoleptique et médicinal spécialement pour leur concentration élevée en antioxydants.
PROPRIÉTÉS PHARMACOLOGIQUES DU BLEUET SAUVAGE
(Vaccinium augustifolium)
Les extraits de bleuets sauvages (Vaccinium augustifolium) possèdent des propriétés antioxydantes qui protègent les cellules contre l’attaque des radicaux libres (11–25). Ces propriétés s’expliquent principalement par la présence de composés antioxydants puissants appelés anthocyanosides (26–34). Plusieurs études chez l’humain démontrent que les anthocyanosides extraits des bleuets sont absorbés par l’organisme et distribués en partie dans le sérum sanguin (35–40). Ces études montrent également que les anthocyanosides des bleuets augmentent la capacité antioxydante du sérum (35–40). Les propriétés pharmacologiques attribuées aux extraits de bleuets sont nombreuses. Des travaux de recherches réalisés chez le rat indiquent que les extraits de bleuets ont des effets bénéfiques sur le cerveau (41–48). Ils protègent les neurones contre la toxicité des radicaux libres. Les auteurs rapportent également que le bleuet améliore significativement les capacités motrices d’animaux âgés (42). D’autres travaux réalisés sur un modèle Alzheimer de souris montrent que le bleuet peut prévenir l’apparition de la maladie malgré les prédispositions génétiques de ces rongeurs (45). De plus, d’autres études menées par ce groupe de recherche rapportent que le bleuet augmente la mémoire et le comportement cognitif des rats (46–48). D’autre part, les extraits de bleuets possèdent des propriétés anticarcinogènes c’est-à-dire qu’ils empêchent la cancérisation des cellules et l’apparition de tumeurs (49–53). Ils bloquent également la croissance tumorale en inhibant la formation des vaisseaux sanguins qui nourrissent la tumeur (angiogénèse) (53–55). Le bleuet contient une quantité importante de resveratrol (56–57). Ce composé inhibe l’agrégation des plaquettes sanguines et l’oxydation des LDL (lipoprotéines de basse densité) (58–59). Le resveratrol a des effets protecteurs sur le système cardiovasculaire et permet de prévenir l’artériosclérose (58–59). L’ensemble des études réalisées à ce jour indique que les antioxydants extraits des bleuets sont bénéfiques pour la santé humaine. Une consommation régulière d’extrait de bleuets sauvages pourrait ralentir le vieillissement et prévenir plusieurs maladies graves comme le cancer, l’Alzheimer et l’artériosclérose.
PROPRIÉTÉS PHARMACOLOGIQUES DES BAIES ROUGES D’AIRELLE (Vaccinium vitis-idaea).
L’airelle est une petite plante ligneuse que l’on retrouve sur les rives du Golf St-Laurent (60). L’airelle produit des baies rouges très riches en composés antioxydants, principalement des composés phénoliques tels que flavonols, anthocyanidines, catechines, caffeoyl et acide férulique (62). Les fruits de l’airelle possèdent des propriétés pharmacologiques très intéressantes. L’activité antioxydante des fruits a été rapportée par plusieurs groupes de recherche (62–67) suggérant que le jus de ce fruit pourrait protéger contre plusieurs maladies graves comme le cancer, les maladies cardiovasculaires et les maladies neurodégénératives. Entre autre, l’extrait de baies rouges inhibe l’oxydation des protéines et des lipides in vitro suggérant que les composés antioxydants présents dans celui-ci pourraient avoir un effet protecteur contre les maladies cardiovasculaires (65). D’autre part, Ho et al. proposent que certains tannins antioxydants présents dans les fruits pourraient être efficaces pour traiter les maladies parodontales (gingivites) responsables de la perte des dents (67). Ces composés inhibent fortement la croissance de Porphyromonas gingivalis et Prevotella intermedia, deux bactéries impliquées dans la gingivite (68). Il est intéressant de noter que des études récentes semblent démontrer que les maladies parodontales sont un facteur de risque important de maladies cardiovasculaires (69). L’activité antibiotique d’extrait de fruits a également été mise en évidence par un groupe de recherche Finlandais (70). Ceux-ci ont démontré que les extraits inhibaient la croissance de plusieurs bactéries et levure humaines pathogènes comme Helicobacter pylori, Bacillus cereus, Campylobacter jejuni, Staphylococcus aureus, Salmonella enterica, Escherichia coli et Candida albicans. Les auteurs suggèrent que l’ellagitannin serait responsable en partie de l’activité antibiotique (71). La médecine traditionnelle suédoise rapporte l’utilisation des fruits de l’airelle pour traiter fièvre, douleur et inflammation. En effet, les fruits semblent efficaces puisque Tunon et al. (72) ont montré qu’un extrait de baies rouges inhibait certains processus liés à l’inflammation.
Références :
| (1) Boveris A, Chance B. (1973). The mitochondrial generation of hydrogen peroxide: general properties and effect of hyperbaric oxygen. Biochem. J. 134 : 707-716. |
| (2) Evans P, Halliwell B. (1999). Free radicals and hearing. Cause, consequence, and criteria. Ann N Y Acad Sci. 28: 19-40. |
| (3) Halliwell B. (1991) Reactive oxygen species in living systems: source, biochemistry, and role in human disease. Am J Med. 91:14S-22S. |
| (4) Halliwell B. (1993). The role of oxygen radicals in human disease, with particular reference to the vascular system. Haemostasis. 23 Suppl 1:118-26. |
| (5) Halliwell B. (2001). Role of free radicals in the neurodegenerative diseases: therapeutic implications for antioxidant treatment. Drugs Aging. 18: 685-716. |
| (6) Inoue M, Sato EF, Nishikawa M, Park AM, Kira Y, Imada I, Utsumi K. (2003). Mitochondrial generation of reactive oxygen species and its role in aerobic life. Curr Med Chem. 10: 2495-505. |
| (7) Djordjevic VB. (2004). Free radicals in cell biology. Int Rev Cytol. 237: 57-89. |
| (8) Halliwell B. (1996) Antioxidants in human health and disease. Annu Rev Nutr. 16: 33-50. |
| (9) Wickens AP. (2001). Ageing and the free radical theory. Respiration Physiology. 128: 379-391. |
| (10) Consortium de recherche sur la forêt boréale commerciale. (2000). Au royaume de la forêt boréale. 64 pages. |
| (11) Cao G, Shukitt-Hale B, Bickford PC, Joseph JA, McEwen J, Prior RL. (1999) Hyperoxia-induced changes in antioxidant capacity and the effect of dietary antioxidants. J Appl Physiol. 86: 1817-22. |
| (12) Kalt W, Forney CF, Martin A, Prior RL. (1999). Antioxidant capacity, vitamin C, phenolics, and anthocyanins after fresh storage of small fruits. J Agric Food Chem. 47: 4638-44. |
| (13) Wang SY, Jiao H. (2000). Scavenging capacity of berry crops on superoxide radicals, hydrogen peroxide, hydroxyl radicals, and singlet oxygen. J Agric Food Chem. 48: 5677-84. |
| (14) Ehlenfeldt MK, Prior RL. (2001). Oxygen radical absorbance capacity (ORAC) and phenolic and anthocyanin concentrations in fruit and leaf tissues of highbush blueberry. J Agric Food Chem. 49: 2222-7. |
| (15) Connor AM, Luby JJ, Hancock JF, Berkheimer S, Hanson EJ. (2002). Changes in fruit antioxidant activity among blueberry cultivars during cold-temperature storage. J Agric Food Chem. 50: 893-8. |
| (16) Halvorsen BL, Holte K, Myhrstad MC, Barikmo I, Hvattum E, Remberg SF, Wold AB, Haffner K, Baugerod H, Andersen LF, Moskaug O, Jacobs DR Jr, Blomhoff R. (2002). A systematic screening of total antioxidants in dietary plants. J Nutr. 132: 461-71. |
| (17) Ono M, Masuoka C, Koto M, Tateishi M, Komatsu H, Kobayashi H, Igoshi K, Ito Y, Okawa M, Nohara T. (2002). Antioxidant ortho-benzoyloxyphenyl acetic acid ester, vaccihein A, from the fruit of rabbiteye blueberry (Vaccinium ashei). Chem Pharm Bull (Tokyo). 50: 1416-7. |
| (18) Zheng W, Wang SY. Oxygen radical absorbing capacity of phenolics in blueberries, cranberries, chokeberries, and lingonberries. (2003). J Agric Food Chem. 51: 502-9. |
| (19) Zheng Y, Wang CY, Wang SY, Zheng W. (2003). Effect of high-oxygen atmospheres on blueberry phenolics, anthocyanins, and antioxidant capacity. J Agric Food Chem. 51: 7162-9. |
| (20) Ichikawa H, Ichiyanagi T, Xu B, Yoshii Y, Nakajima M, Konishi T. (2001). Antioxidant Activity of Anthocyanin Extract from Purple Black Rice. J Med Food. 4: 211-218. |
| (21) Prior RL, Hoang H, Gu L, Wu X, Bacchiocca M, Howard L, Hampsch-Woodill M, Huang D, Ou B, Jacob R. (2003). Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORAC(FL))) of plasma and other biological and food samples. J Agric Food Chem. 51: 3273-9. |
| (22) Cevallos-Casals BA, Cisneros-Zevallos L. (2003). Stoichiometric and kinetic studies of phenolic antioxidants from Andean purple corn and red-fleshed sweetpotato. J Agric Food Chem. 51: 3313-9. |
| (23) Blomhoff R. Antioxidants and oxidative stress. (2004). Tidsskr Nor Laegeforen. 124: 1643-5. |
| (24) Lichtenthaler R, Marx F. (2005). Total oxidant scavenging capacities of common European fruit and vegetable juices. J Agric Food Chem. 53: 103-10. |
| (25) Parry J, Su L, Luther M, Zhou K, Yurawecz MP, Whittaker P, Yu L. (2005). Fatty acid composition and antioxidant properties of cold-pressed marionberry, boysenberry, red raspberry, and blueberry seed oils. J Agric Food Chem. 53: 566-73. |
| (26) Ichiyanagi T, Tateyama C, Oikawa K, Konishi T. (2000). Comparison of anthocyanin distribution in different blueberry sources by capillary zone electrophoresis. Biol Pharm Bull. 23: 492-7. |
| (27) Ichiyanagi T, Oikawa K, Tateyama C, Konishi T. (2001). Acid mediated hydrolysis of blueberry anthocyanins. Chem Pharm Bull (Tokyo). 49: 114-7. |
| (28) Kalt W, Ryan DA, Duy JC, Prior RL, Ehlenfeldt MK, Vander Kloet SP. (2001). Interspecific variation in anthocyanins, phenolics, and antioxidant capacity among genotypes of highbush and lowbush blueberries (Vaccinium section cyanococcus spp.). J Agric Food Chem. 49: 4761-7. |
| (29) Sellappan S, Akoh CC, Krewer G. Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries. (2002). J Agric Food Chem. 50: 2432-8. |
| (30) Gu L, Kelm M, Hammerstone JF, Beecher G, Cunningham D, Vannozzi S, Prior RL. (2002). Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method. J Agric Food Chem. 50: 4852-60. |
| (31) Sanchez-Moreno C, Cao G, Ou B, Prior RL. (2003). Anthocyanin and proanthocyanidin content in selected white and red wines. Oxygen radical absorbance capacity comparison with nontraditional wines obtained from highbush blueberry. J Agric Food Chem. 51: 4889-96. |
| (32) Taruscio TG, Barney DL, Exon J. (2004). Content and profile of flavanoid and phenolic acid compounds in conjunction with the antioxidant capacity for a variety of northwest Vaccinium berries. J Agric Food Chem. 52: 3169-76. |
| (33) Schmidt BM, Howell AB, McEniry B, Knight CT, Seigler D, Erdman JW Jr, Lila MA. (2004). Effective separation of potent antiproliferation and antiadhesion components from wild blueberry (Vaccinium angustifolium Ait.) fruits. J Agric Food Chem. 52: 6433-42. |
| (34) Nakajima JI, Tanaka I, Seo S, Yamazaki M, Saito K. (2004). LC/PDA/ESI-MS Profiling and Radical Scavenging Activity of Anthocyanins in Various Berries. J Biomed Biotechnol. 2004: 241-247. |
| (35) Pedersen CB, Kyle J, Jenkinson AM, Gardner PT, McPhail DB, Duthie GG. (2000). Effects of blueberry and cranberry juice consumption on the plasma antioxidant capacity of healthy female volunteers. Eur J Clin Nutr. 54: 405-8. |
| (36) Wu X, Cao G, Prior RL. (2002). Absorption and metabolism of anthocyanins in elderly women after consumption of elderberry or blueberry. J Nutr. 132: 1865-71. |
| (37) Kay CD, Holub BJ. (2002). The effect of wild blueberry (Vaccinium angustifolium) consumption on postprandial serum antioxidant status in human subjects. Br J Nutr. 88: 389-98. |
| (38) Mazza G, Kay CD, Cottrell T, Holub BJ. (2002). Absorption of anthocyanins from blueberries and serum antioxidant status in human subjects. J Agric Food Chem. 50: 7731-7. |
| (39) Kay CD, Mazza G, Holub BJ, Wang J. (2004). Anthocyanin metabolites in human urine and serum. Br J Nutr. 91: 933-42. |
| (40) Ichiyanagi T, Rahman MM, Kashiwada Y, Ikeshiro Y, Shida Y, Hatano Y, Matsumoto H, Hirayama M, Tsuda T, Konishi T. (2004). Absorption and metabolism of delphinidin 3-O-beta-D-glucopyranoside in rats. Free Radic Biol Med. 36: 930-7. |
| (41) Joseph JA, Denisova N, Fisher D, Shukitt-Hale B, Bickford P, Prior R, Cao G. (1998). Membrane and receptor modifications of oxidative stress vulnerability in aging. Nutritional considerations. Ann N Y Acad Sci. 854: 268-76. |
| (42) Joseph JA, Shukitt-Hale B, Denisova NA, Bielinski D, Martin A, McEwen JJ, Bickford PC. (1999). Reversals of age-related declines in neuronal signal transduction, cognitive, and motor behavioral deficits with blueberry, spinach, or strawberry dietary supplementation. J Neurosci. 19: 8114-21. |
| (43) Joseph JA, Denisova NA, Bielinski D, Fisher DR, Shukitt-Hale B. (2000). Oxidative stress protection and vulnerability in aging: putative nutritional implications for intervention. Mech Ageing Dev. 116: 141-53. |
| (44) Galli RL, Shukitt-Hale B, Youdim KA, Joseph JA. (2002). Fruit polyphenolics and brain aging: nutritional interventions targeting age-related neuronal and behavioral deficits. Ann N Y Acad Sci. 959: 128-32. |
| (45) Joseph JA, Denisova NA, Arendash G, Gordon M, Diamond D, Shukitt-Hale B, Morgan D. (2003). Blueberry supplementation enhances signaling and prevents behavioral deficits in an Alzheimer disease model. Nutr Neurosci. 6: 153-62. |
| (46) Goyarzu P, Malin DH, Lau FC, Taglialatela G, Moon WD, Jennings R, Moy E, Moy D, Lippold S, Shukitt-Hale B, Joseph JA. (2004). Blueberry supplemented diet: effects on object recognition memory and nuclear factor-kappa B levels in aged rats. Nutr Neurosci. 7: 75-83. |
| (47) Joseph JA, Shukitt-Hale B, Casadesus G. (2005). Reversing the deleterious effects of aging on neuronal communication and behavior: beneficial properties of fruit polyphenolic compounds. Am J Clin Nutr. 81(1 Suppl): 313S-316S. |
| (48) Casadesus G, Shukitt-Hale B, Stellwagen HM, Zhu X, Lee HG, Smith MA, Joseph JA. (2004). Modulation of hippocampal plasticity and cognitive behavior by short-term blueberry supplementation in aged rats. Nutr Neurosci. 7: 309-16. |
| (49) Bomser J, Madhavi DL, Singletary K, Smith MA. (1996). In vitro anticancer activity of fruit extracts from Vaccinium species. Planta Med. 62: 212-6. |
| (50) Kapadia GJ, Azuine MA, Tokuda H, Hang E, Mukainaka T, Nishino H, Sridhar R. (2002). Inhibitory effect of herbal remedies on 12-O-tetradecanoylphorbol-13-acetate-promoted Epstein-Barr virus early antigen activation. Pharmacol Res. 45: 213-20. |
| (51) Wedge DE, Meepagala KM, Magee JB, Smith SH, Huang G, Larcom LL. (2001). Anticarcinogenic Activity of Strawberry, Blueberry, and Raspberry Extracts to Breast and Cervical Cancer Cells. J Med Food. 4: 49-51. |
| (52) Hope Smith S, Tate PL, Huang G, Magee JB, Meepagala KM, Wedge DE, Larcom LL. (2004). Antimutagenic activity of berry extracts. J Med Food. 7: 450-5. |
| (53) Bagchi D, Sen CK, Bagchi M, Atalay M. (2004). Anti-angiogenic, antioxidant, and anti-carcinogenic properties of a novel anthocyanin-rich berry extract formula. Biochemistry (Mosc). 69: 75-80, 1 p preceding 75. |
| (54) Roy S, Khanna S, Alessio HM, Vider J, Bagchi D, Bagchi M, Sen CK. (2002). Anti-angiogenic property of edible berries. Free Radic Res. 36: 1023-31. |
| (55) Atalay M, Gordillo G, Roy S, Rovin B, Bagchi D, Bagchi M, Sen CK. (2003). Anti-angiogenic property of edible berry in a model of hemangioma. FEBS Lett. 544: 252-7. |
| (56) Lyons MM, Yu C, Toma RB, Cho SY, Reiboldt W, Lee J, van Breemen RB. (2003). Resveratrol in raw and baked blueberries and bilberries. J Agric Food Chem. 51: 5867-70. |
| (57) Rimando AM, Kalt W, Magee JB, Dewey J, Ballington JR. (2004). Resveratrol, pterostilbene, and piceatannol in vaccinium berries. J Agric Food Chem. 52: 4713-9. |
| (58) Fremont L. (2000). Biological effects of resveratrol. Life Sci. 66: 663-73. |
| (59) Wu JM, Wang ZR, Hsieh TC, Bruder JL, Zou JG, Huang YZ. (2001). Mechanism of cardioprotection by resveratrol, a phenolic antioxidant present in red wine (Review). Int J Mol Med. 8: 3-17. |
| (60)Frère Marie-Victorin. (1964). Flore Laurentienne. Les presses de l’Université de Montréal. 2iem édition. P.439. |
| (61) Ek S, Kartimo H, Mattila S, Tolonen A. (2006). Characterization of phenolic compounds from lingonberry (Vaccinium vitis-idaea). J Agric Food Chem. 54: 9834-42. |
| (62) Wang SY, Feng R, Bowman L, Penhallegon R, Ding M, Lu Y. (2005) Antioxidant activity in lingonberries (Vaccinium vitis-idaea L.) and its inhibitory effect on activator protein-1, nuclear factor-kappaB, and mitogen-activated protein kinases activation. J Agric Food Chem. 53: 3156-66. |
| (63) Viljanen K, Kylli P, Hubbermann EM, Schwarz K, Heinonen M. (2005). Anthocyanin antioxidant activity and partition behavior in whey protein emulsion. J Agric Food Chem. 53: 2022-7. |
| (64) Lichtenthaler R, Marx F. (2005) Total oxidant scavenging capacities of common European fruit and vegetable juices. J Agric Food Chem. 53: 103-10. |
| (65) Viljanen K, Kylli P, Kivikari R, Heinonen M. (2004). Inhibition of protein and lipid oxidation in liposomes by berry phenolics. J Agric Food Chem. 52: 7419-24. |
| (66) Zheng W, Wang SY. (2003). Oxygen radical absorbing capacity of phenolics in blueberries, cranberries, chokeberries, and lingonberries. J Agric Food Chem. 51: 502-9. |
| (67) Ho KY, Huang JS, Tsai CC, Lin TC, Hsu YF, Lin CC (1999). Antioxidant activity of tannin components from Vaccinium vitis-idaea L. J Pharm Pharmacol. 51: 1075-8. |
| (68) Ho KY, Tsai CC, Huang JS, Chen CP, Lin TC, Lin CC. Antimicrobial activity of tannin components from Vaccinium vitis-idaea L. (2001). J Pharm Pharmacol. 53: 187-91. |
| (69) Gotsman I, Lotan C, Soskolne WA, Rassovsky S, Pugatsch T, Lapidus L, Novikov Y, Masrawa S, Stabholz A. (2007). Periodontal Destruction Is Associated With Coronary Artery Disease and Periodontal Infection With Acute Coronary Syndrome. J Periodontol. 78: 849-858. |
| (70) Nohynek LJ, Alakomi HL, Kahkonen MP, Heinonen M, Helander IM, Oksman-Caldentey KM, Puupponen-Pimia RH. (2006) Berry phenolics: antimicrobial properties and mechanisms of action against severe human pathogens. Nutr Cancer. 54:18-32. |
| (71) Puupponen-Pimia R, Nohynek L, Hartmann-Schmidlin S, Kahkonen M, Heinonen M, Maatta-Riihinen K, Oksman-Caldentey KM. (2005). Berry phenolics selectively inhibit the growth of intestinal pathogens. J Appl Microbiol. 98: 991-1000. |
| (72) Tunon H, Olavsdotter C, Bohlin L. (1995). Evaluation of anti-inflammatory activity of some Swedish medicinal plants. Inhibition of prostaglandin biosynthesis and PAF-induced exocytosis. J Ethnopharmacol. 48: 61-76. |
| (73) Paivarinta E, Pajari AM, Torronen R, Mutanen M. (2006). Ellagic acid and natural sources of ellagitannins as possible chemopreventive agents against intestinal tumorigenesis in the Min mouse. Nutr Cancer. 54:79-83. |
| (74) Aggarwal BB, Shishodia S. (2006). Molecular targets of dietary agents for prevention and therapy of cancer. Biochem Pharmacol. 71:1397-421. |
| (75) Barta I, Smerak P, Polivkova Z, Sestakova H, Langova M, Turek B, Bartova J. (2006) Current trends and perspectives in nutrition and cancer prevention. Neoplasma. 53:19-25. |
| (76) Huetz P, Mavaddat N, Mavri J. (2005). Reaction between ellagic acid and an ultimate carcinogen. J Chem Inf Model. 45: 1564-70. |
| (77) Pavlica S, Gebhardt R. (2005). Protective effects of ellagic and chlorogenic acids against oxidative stress in PC12 cells. Free Radic Res. 39: 1377-90. |
| (78) Dorai T, Aggarwal BB. (2004). Role of chemopreventive agents in cancer therapy. Cancer Lett. 215: 129-40. |
| (79) Festa F, Aglitti T, Duranti G, Ricordy R, Perticone P, Cozzi R. (2001). Strong antioxidant activity of ellagic acid in mammalian cells in vitro revealed by the comet assay. Anticancer Res. 21: 3903-8. |
| (80) Wargovich MJ. (1997). Experimental evidence for cancer preventive elements in foods. Cancer Lett. 114: 11-7. |
(81) Stoner GD, Mukhtar H. Polyphenols as cancer chemopreventive agents. (1995). J Cell Biochem Suppl. 22:169-80. |
| (82) Szarka CE, Grana G, Engstrom PF. (1994). Chemoprevention of cancer. Curr Probl Cancer. 18: 6-79. |
| (83) Kelloff GJ, Boone CW, Crowell JA, Steele VE, Lubet R, Sigman CC. (1994) Chemopreventive drug development: perspectives and progress. Cancer Epidemiol Biomarkers Prev. 3: 85-98. |